آمونیاک چیست؟
آمونیاک (ammonia) با فرمول شیمیایی NH3 یک گاز بی رنگ با بوی تند و تیز است که به راحتی تحت فشار متراکم میشود و به مایع بی رنگ و شفاف تبدیل میگردد و بصورت گسترده در ایالات متحده آمریکا تولید می شود.
گاز آمونیاک خاصیت تحریک کنندگی بالا دارد. این ماده به راحتی در آب حل میشود و محلول آمونیوم هیدروکسید را تشکیل میدهد که بسیار تحریک کننده بوده و باعث سوختگی میشود. آمونیاک را میتوان از منابع طبیعی و مصنوعی تهیه کرد.
خرید عمده آمونیاک صنعتی از فروشنده معتبر در تهران:
آمونیاک یک ماده شیمیایی مهم است که در مقیاس ۱۵۰ میلیون تن در سال تولید می شود. در واقع نیمی از هیدروژن تولید شده در صنایع شیمیایی برای تولید آمونیاک استفاده می شود. آمونیاک را در گریدهای مختلف می توانید به راحتی از شرکت های معتبر تولید و توزیع مواد شیمیایی همچون پتروآلتون بصورت آنلاین و حضوری تهیه نمایید.
قیمت خرید و فروش عمده آمونیاک صنعتی:
عوامل بسیار زیادی مثل انواع گریدهای محصولات شیمیایی بر اساس درصد خلوص، نرخ ارز، قیمت جهانی، بورس کالا، بر قیمت خرید و فروش مواد شیمیایی تاثیر گذار هستند. در ایران قیمت فروش مواد شیمیایی بر پایه قیمتهای جهانی مشخص میگردد. به همین دلیل، جهت محاسبه قیمت نهایی این مواد، باید قیمت جهانی آن را در قیمت دلار ضرب کرد تا نرخ ریالی آن به دست بیاید.جهت اطلاع از قیمت خرید و فروش عمده آمونیاک میتوانید از کارشناسان پتروآلتون مشاوره بگیرید.
ساختار مولکولی آمونیاک :
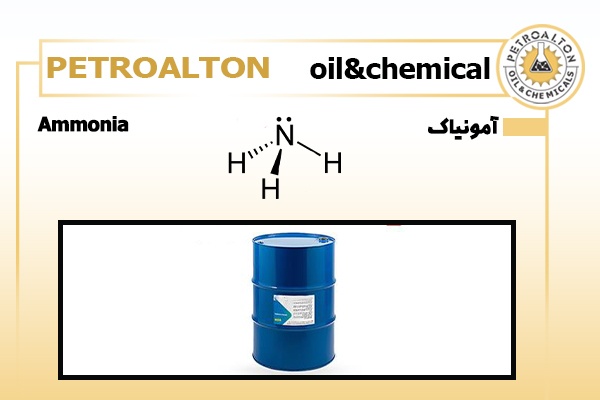
فرمول شیمیایی آمونیاک:
گاز نیتروژن و هیدروژن با هم ترکیب شده وآمونیاک با فرمول شیمیایی آمونیاک NH3 تولید میشود.
جدول مشخصات فنی آمونیاک مایع :
|
جرم مولی آمونیاک |
17.03 گرم بر مول |
|
میزان خلوص |
بیش از 25 درصد |
|
نقطه جوش آمونیاک |
24.7 درجه سانتی گراد |
|
نقطه ذوب |
91.5- درجه سانتی گراد |
|
دانسیته |
0.903 گرم بر سانتی متر مکعب |
| شکل ظاهری |
مایع بی رنگ همراه با بوی خیلی تند |
جدول مشخصات فنی آمونیاک گازی:
|
حالت |
گاز |
|
جرم مولی استاندارد |
17.03گرم بر مول |
|
نقطه ذوب |
77.73- درجه سانتی گراد |
|
نقطه جوش |
33.34- درجه سانتی گراد |
|
دمای خود اشتعالی |
651درجه سانتی گراد |
کاربردهای آمونیاک در صنایع
کاربرد آمونیاک در کشاورزی
آمونیاک (NH₃) واقعاً یک ستاره در دنیای شیمی و صنعت به حساب میاد! کاربردهاش اونقدر گسترده و حیاتیه که اگه نبود، خیلی از جنبههای زندگی امروزی ما حسابی تغییر میکرد. بذارید به مهمترین و پرکاربردترین هاش اشاره کنم:

1. کشاورزی (کودهای شیمیایی) – مهمترین و اصلیترین کاربرد
بیش از 80 درصد آمونیاک تولید شده در جهان صرف تولید کودهای نیتروژنه میشه. بدون این کودها، تولید مواد غذایی فعلی برای جمعیت رو به رشد جهان تقریباً غیرممکن بود.
- اوره: پرمصرفترین کود نیتروژنه که از آمونیاک و دیاکسید کربن تولید میشه.
- نیترات آمونیوم: کود نیتروژنه قوی که هم در کشاورزی و هم در صنایع دیگر کاربرد داره.
- سولفات آمونیوم، فسفات آمونیوم: انواع دیگری از کودها که نیتروژن رو همراه با سایر عناصر مورد نیاز گیاه (مثل گوگرد و فسفر) فراهم میکنن.
- آمونیاک بیکربنات: استفاده مستقیم از آمونیاک مایع یا گازی به عنوان کود در برخی مزارع (البته با احتیاط و تجهیزات خاص).
2.کاربرد آمونیاک در پاککنندهها و شویندهها
محلول آمونیاک در آب (آب آمونیاک یا آمونیوم هیدروکسید) یک پاککننده قوی و موثره:
- شیشهپاککنها: به دلیل توانایی در از بین بردن چربی و بدون گذاشتن رگه.
- پاککنندههای عمومی خانگی: برای تمیز کردن سطوح مختلف.
- پاککنندههای صنعتی: در مقیاس بزرگتر برای تمیزکاریهای صنعتی.

3.صنایع تبرید (خنککننده)
آمونیاک به دلیل ظرفیت گرمایی بالا و نقطه جوش مناسب، یک مبرد (refrigerant) بسیار موثره و در صنایع تبرید در مقیاس بزرگ کاربرد زیادی داره:
- سردخانههای صنعتی: برای نگهداری مواد غذایی و دارویی در دمای پایین.
- تولید یخ: در کارخانههای تولید یخ.
- سیستمهای تهویه مطبوع بزرگ: در ساختمانهای تجاری و صنعتی بزرگ.
- صنایع پتروشیمی: در فرآیندهای خنکسازی مختلف.
- نکته: هرچند آمونیاک بوی تندی داره و سمیه، اما دوستدار محیطه و به لایه ازون آسیبی نمیرسونه.
4. صنایع شیمیایی و داروسازی
آمونیاک یک ماده اولیه کلیدی برای تولید طیف وسیعی از مواد شیمیاییه:
- تولید اسید نیتریک (HNO₃): از آمونیاک برای تولید اسید نیتریک استفاده میشه که خودش در تولید کودها، مواد منفجره، رنگها و داروها به کار میره.
- مواد منفجره: نیترات آمونیوم (ANFO) و سایر مواد منفجره بر پایه نیتروژن از آمونیاک تولید میشن.
- فیبرها و پلاستیکها: تولید نایلون، پلیاورتان و سایر پلیمرها از مشتقات آمونیاک آغاز میشه.
- داروسازی: در تولید برخی داروها، ویتامینها (مثل ویتامینهای B کمپلکس) و مواد دارویی از آمونیاک یا مشتقات اون استفاده میشه.
- رنگها و رنگدانهها: در ساخت بسیاری از رنگهای مصنوعی و رنگدانهها آمونیاک به کار میره.
5. تصفیه آب و فاضلاب
-
- خنثیسازی اسیدها: در تصفیه فاضلابهای صنعتی برای خنثی کردن پسابهای اسیدی.
- ضد عفونی: در برخی موارد به همراه کلر برای تولید کلرامینها (chloramines) که به عنوان ضدعفونیکننده آب آشامیدنی استفاده میشن و پایداری بیشتری نسبت به کلر تنها دارن.

6. متالورژی
- نیتروژندهی فلزات (Nitrogenation): برای سخت کردن سطح فلزات و افزایش مقاومت به سایش و خوردگی. در این فرآیند، قطعات فلزی در معرض گاز آمونیاک در دماهای بالا قرار میگیرن.
- آهنگری: در برخی فرآیندهای آهنگری و عملیات حرارتی فلزات.
7. صنایع نساجی
- تولید الیاف مصنوعی: در فرآیند تولید برخی الیاف مثل ریون و نایلون.
- رنگرزی: به عنوان یک عامل کمکی در فرآیندهای رنگرزی پارچه.
8. کنترل آلودگی هوا
- کاهش اکسیدهای نیتروژن (DeNOx): در نیروگاهها و صنایع بزرگ، آمونیاک تزریق میشه تا با اکسیدهای نیتروژن (NOx) موجود در گازهای خروجی واکنش داده و اونها رو به نیتروژن و آب تبدیل کنه و از این طریق آلودگی هوا رو کاهش بده (کاتالیزورهای SCR و SNCR).
9. پزشکی و داروسازی (کاربردهای خاص)
- نمکهای آمونیاکی (Smelling Salts): برای تحریک سیستم تنفسی افراد بیهوش یا دچار غش.
- تنظیم pH: در فرآیندهای داروسازی برای تنظیم اسیدیته یا قلیائیت.
روش تولید آمونیاک:
آمونیاک (NH₃) یکی از مهمترین ترکیبات شیمیایی در دنیاست و نقش حیاتی در کشاورزی (تولید کود) و صنایع شیمیایی داره. تولید آمونیاک به دلیل نیاز گستردهای که بهش هست، فرآیندهای صنعتی پیچیدهای رو شامل میشه. اصلیترین و تقریباً تنها روش صنعتی برای تولید آمونیاک، فرآیند هابر-بوش (Haber-Bosch Process) هست.
بگذارید کمی در مورد این فرآیند فوقالعاده مهم و سایر روشها (که بیشتر جنبه تاریخی یا آزمایشگاهی دارن) صحبت کنیم:
1. فرآیند هابر-بوش (The Haber-Bosch Process) – قهرمان بلامنازع تولید آمونیاک
این فرآیند، که توسط فریتز هابر در اوایل قرن بیستم توسعه یافت و کارل بوش آن را در مقیاس صنعتی پیادهسازی کرد، یکی از بزرگترین دستاوردهای مهندسی شیمی محسوب میشه و نقش بسزایی در تغذیه جمعیت رو به رشد جهان داشته.
اصول واکنش:
فرآیند هابر-بوش بر اساس واکنش مستقیم نیتروژن گازی (N₂) از هوا و هیدروژن گازی (H₂) عمل میکنه:
N₂(g) + 3H₂(g) ⇌ 2NH₃(g)
این واکنش یک واکنش تعادلی و گرمازا هست.
شرایط مورد نیاز برای بهینه سازی تولید آمونیاک:
- دما: اگرچه واکنش گرمازا است و دمای پایینتر تعادل را به سمت تولید آمونیاک شیفت میدهد، اما در دمای پایین سرعت واکنش به شدت کمه. برای همین، از دمای بالا (معمولاً بین 400 تا 500 درجه سانتیگراد) استفاده میشه تا سرعت واکنش به حد قابل قبولی برسه.
- فشار: افزایش فشار باعث میشه که تعادل به سمت محصول (آمونیاک) شیفت پیدا کنه، چون تعداد مولهای گازی در سمت واکنشدهندهها (1+3=4) بیشتر از سمت محصولات (2) هست. به همین دلیل، این فرآیند در فشارهای بسیار بالا (معمولاً 150 تا 350 اتمسفر و حتی بیشتر) انجام میشه.
- کاتالیزور: برای افزایش سرعت واکنش در دماهای نسبتاً پایین (که هنوز بالاست اما نه آنقدر که آمونیاک تجزیه شود)، از کاتالیزور استفاده میشه. کاتالیزور رایج در این فرآیند، آهن (معمولاً اکسید آهن که در حین فرآیند احیا میشه) به همراه مواد افزاینده (promoters) مثل اکسید آلومینیوم (Al₂O₃) و اکسید پتاسیم (K₂O) هست.
مراحل کلی فرآیند هابر-بوش:
- تولید هیدروژن: هیدروژن معمولاً از متان (گاز طبیعی) و بخار آب (Steam Reforming) تولید میشه:CH₄(g) + H₂O(g) → CO(g) + 3H₂(g)و سپس CO نیز با بخار آب واکنش داده و هیدروژن بیشتری تولید میکنه (Shift Reaction):CO(g) + H₂O(g) → CO₂(g) + H₂(g)دیاکسید کربن تولید شده حذف میشه. روشهای دیگر تولید هیدروژن شامل الکترولیز آب یا گازیسازی زغالسنگ نیز هستند، اما Steam Reforming متان رایجتره.
- تولید نیتروژن: نیتروژن مستقیماً از هوای مایع با استفاده از فرآیند تقطیر جزء به جزء (Fractional Distillation) به دست میاد.
- تراکم و ترکیب گازها: گازهای نیتروژن و هیدروژن با نسبت مولی 1 به 3 (استوکیومتری واکنش) ترکیب و فشرده میشن.
- راکتور کاتالیزوری: مخلوط گازها وارد راکتور حاوی کاتالیزور آهن میشه و در دما و فشار بالا واکنش میدن. تنها حدود 15 تا 20 درصد از گازها در هر عبور به آمونیاک تبدیل میشن.
- جداسازی آمونیاک: آمونیاک تولید شده، سرد شده و به حالت مایع در میاد و از گازهای واکنشنداده (نیتروژن و هیدروژن) جدا میشه.
- بازیافت گازهای واکنشنداده: گازهای نیتروژن و هیدروژن واکنشنداده دوباره به چرخه فرآیند برگردونده میشن تا کارایی فرآیند رو افزایش بدن.
2. روشهای تاریخی یا آزمایشگاهی (که امروزه صنعتی نیستند):
- تولید از سیانامید کلسیم (Frank-Caro Process): این روش پیش از هابر-بوش استفاده میشد. در این فرآیند، نیتروژن با کاربید کلسیم واکنش داده و سیانامید کلسیم تولید میکرد که سپس با آب واکنش داده و آمونیاک آزاد میشد.
- واکنش نیتریدها با آب: نیتریدهای فلزی (مثل نیترید منیزیم) با آب واکنش داده و آمونیاک تولید میکنن:Mg₃N₂(s) + 6H₂O(l) → 3Mg(OH)₂(s) + 2NH₃(g)این روش بیشتر جنبه آزمایشگاهی داره.
- الکترولیز آب و تولید نیتروژن از هوا (روشهای اولیه): در گذشته روشهای غیربهینه و پرهزینهتری برای تولید آمونیاک وجود داشت که به دلیل هزینه بالا و کارایی پایین، با ظهور هابر-بوش کنار گذاشته شدند.
چرا هابر-بوش اینقدر مهمه؟
قبل از فرآیند هابر-بوش، منبع اصلی نیتروژن برای کودها، نمکهای نیترات طبیعی (مثل نیترات شیلی) بود که منابع محدودی داشت. هابر-بوش امکان تثبیت نیتروژن از هوای نامحدود رو فراهم کرد و به این ترتیب، به حل مشکل کمبود غذا در جهان کمک شایانی کرد. این فرآیند همچنین پایه و اساس تولید بسیاری از مواد شیمیایی نیتروژندار دیگر، از جمله مواد منفجره و داروها، هست.
معروفترین تولیدکنندگان آمونیاک در ایران:
- پتروشیمی رازی
- پتروشیمی خراسان
- پتروشیمی شیراز
- پتروشیمی کرمانشاه
- پتروشیمی مسجد سلیمان
تولید اسید نیتریک با اکسیداسیون آمونیاک
موثرترین روش تولید اسید نیتریک با استفاده از مواد اولیه آمونیاک است. این روش بهره وری بالایی دارد و انرژی کمتری مصرف میکند. در این روش آمونیاک با اکسیژن در حضور کاتالیزور واکنش میدهند.
در این روش ابتدا گاز اکسیژن O2 از طریق تقطیر تولید میشود.
آمونیاک NH3 با اکسیژن و در حضور کاتالیزوری مانند آلومینیوم اکسیده میشود.
(g) 6H2O (g) +4NO (g) = 5O2 (g) +4NH3
سپس نیتروژن تولید شده به نیتروژن دی اکسید اکسیده میشود.
(g) 2NO2 (g) = O2 (g) + 2NO
در مرحله بعد دیاکسید نیتروژن (NO2) با آب واکنش داده و به اسید نیتریک تبدیل میشود. واکنش اینگونه است:
(g) NO (g) + 2HNO3 (aq) = H2O (l) + 3NO2
بعد از آن اسید نیتریک را از محلول به دست آمده جدا کرده و آماده مصرف میشود.
MSDS و خطرات آمونیاک:
آمونیاک مایع و غلیظ بسیار خطرناک است و خاصیت سوزانندگی دارد. این ماده وقتی در تماس با پوست، چشم یا دهان قرار گیرد، در اثر واکنش با رطوبت موجود در بافتها، ماده ای سوزاننده به نام امونیوم هیدروکسید تولید میکند که باعث آسیب به لیپیدهای موجود در غشای سلول میشود و التهاب ایجاد میکند. بلعیدن این ماده نیز میتواند درد شدید در ناحیه شکم ایجاد کند.
در صورت تماس این ماده با چشم، باید با مقدار آب زیادی شسته شود.
شرایط نگهداری آمونیاک:
در شرایط نرمال نگهداری، با توجه به اینکه این محصول پایدار است، واکنش مضر و مخربی رخ نمیدهد. برای ایجاد شرایط مناسب باید به نکات زیر توجه کنید:
- در مکانی با تهویه مناسب و به دور از نور مستقیم خورشید نگهداری شود.
- در محیطی به دور از شعله یا جرقه احتمالی نگهداری شود.
- به دور از مواد ناسازگار مانند اکسید کنندهها و فلزات زرد همچون برنج و مس نگهداری شود.
- ظروف نگهداری آمونیاک نباید تحت فشار، برش، جوشکاری و لحیم کاری قرار گیرد.
- برای حمل و نقل از چرخ دستی استفاده کنید و از غلتاندن یا کشیدن سیلندرها خودداری نمایید.






هنوز بررسیای ثبت نشده است.